
渗透压是在溶液和水置于中间安置选透膜的U型管中端施加阻止水渗透的压力。渗透压的大小和溶液的体积摩耳浓度、溶液温度和溶质解离度相关,因此有时若得之渗透压的大小和其他条件,可以反推出大分子的分子量。范荷夫因为渗透压和化学动力学等方面的研究获得*届诺贝尔化学奖。依照范荷夫定律,稀溶液的渗透压与溶液的体积摩耳浓度及温度成正比。
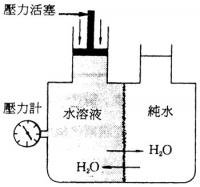 渗透压将溶液和水置于U型管中,在U型管中间安置个半透膜,以隔开水和溶液,可以见到水通过半透膜往溶液端跑,假设在溶液端施加压强,而此压强可刚好阻止水的渗透,则称此压强为渗透压,渗透压的大小和溶液的重量摩尔浓度、溶液温度和溶质解离度相关,因此有时若得知渗透压的大小和其他条件,可以反推出溶质分子的分子量。
渗透压将溶液和水置于U型管中,在U型管中间安置个半透膜,以隔开水和溶液,可以见到水通过半透膜往溶液端跑,假设在溶液端施加压强,而此压强可刚好阻止水的渗透,则称此压强为渗透压,渗透压的大小和溶液的重量摩尔浓度、溶液温度和溶质解离度相关,因此有时若得知渗透压的大小和其他条件,可以反推出溶质分子的分子量。
溶液浓度越大,渗透压越大
渗透压:水分子经半透膜入蔗糖溶液,而溶质(这是蔗糖)不会透过半透膜。单位体积清水中的水分子比单位体积蔗糖溶液中的水分子多,所以在单位时间内水分子由烧杯透过半透膜入漏斗内的数量多于水分子由漏斗入烧杯中的数量。水分子总是从水多的地方到水少的地方,即从浓度低的溶液到浓度的溶液。因此产生静水压力,如果在溶液的上方施加个压力,其大小恰好阻止水分子的净渗入,这个压力产生的压强数值就是该溶液在该浓度下的渗透压(osmotic pressure),用符号π表示,单位:atm。
π的大小可用渗透计测定,或用渗透平衡时出水面的溶液对下产生的静水压力表示(h×s × 比重=体积× 比重)。也可用Vant Hoff提出的公式计算:
1886年范霍夫(J.H.van’t Hoff)根据实验数据得出条规律:对稀溶液来说,渗透压与溶液的浓度和温度成正比,它的比例常数就是气体状态方程式中的常数R。这条规律称为范荷甫定律。用方程式表示如下: πV=nRT
或π=cRT
式中π为稀溶液的渗透压,V为溶液的体积,c为溶液的浓度,R为气体常数,n为溶质的物质的量,T为温度。
上式称为范荷甫公式,也叫渗透压公式。常数R的数值与π和V的单位有关,当π的单位为kPa,V的单位为升(L)时,R值为8.31kPa·L·K-1·mol-1。
范荷甫公式表示,在定温度下,溶液的渗透压与单位体积溶液中所含溶质的粒子数(分子数或离子数)成正比,而与溶质的本性无关。
②渗透压 osmotic pressure
隔以半透膜,方为溶酶的水,另方为溶液,水通过半透膜向溶液方渗透。为阻止水的移动在溶液侧所加的压力称为渗透压。水的运动之所以停止,是该压力与通过膜的水的化学势能相等所致。重量克分子浓度Cs的溶液渗透压П,近似于П=CsRT(R:气体常数,T:温度)。如用容积克分子浓度,能得到比理论值更大的实测值。液胞很发达的植物细胞,与细胞体积V之间存在着ПV=定值的关系;但在动物等细胞质多的细胞,从V中减去渗透不活性分(非水相)的细胞容积时,上式也成立。在植物细胞,细胞质和细胞液保持渗透压平衡。细胞液的渗透压限定细胞质的含水量,而影响细胞质粘性等物理化学性质。此外渗透压还能使之产生膨胀压以调节细胞的生长和膨胀运动。细胞具有调节渗透压的作用,此称渗透压调节(osmoregulation)。就如动物体液那样,浸渍组织的内环境的渗透压,也具有很大的生理影响。渗透压可以用气压、冰点下降度(△)或者渗透克分子浓度等来表示。
上一篇 : 闭口闪点测定仪的测试标准
下一篇 : 直电阻快速测试仪的日常维护
